Il concetto di particella subatomica
Sebbene il primo modello atomico sia stato messo per iscritto nel 1803 il concetto di atomo è molto più antico e risale addirittura all’antica Grecia.
Il termine ἄτομος in greco antico significa “indivisibile” e nacque dalle riflessioni sulla natura delle cose da parte di Democrito, Leucippo ed Epicuro. Nella loro concezione si trattava di particelle così piccole da non poter essere divise ulteriormente, e così si credette fino ai primi anni del 1800.
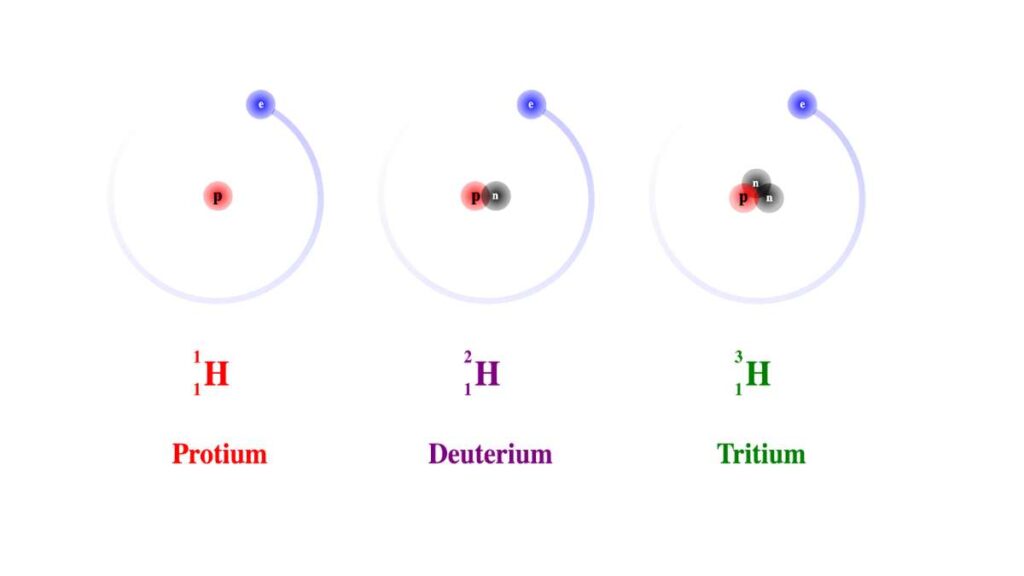
Come oggi sappiamo gli atomi non sono affatto unità indivisibili perché al loro interno possiamo trovare più tipologie di particelle di massa infinitesima. Le tre che studiamo di più sono gli elettroni, i protoni e i neutroni, ma ne esistono diverse altre come i neutrini, i tautoni ecc.
La moderna struttura dell’atomo
Senza ripercorrere l’evoluzione del modello atomico da Dalton a quello meccanico quantistico, vediamo di definire come è organizzata l’unità atomica come la conosciamo oggi.
Volendo descriverla in maniera molto semplificata abbiamo un nucleo centrale composto da due tipologie di particelle: protoni e neutroni.
Nella regione di spazio che circonda il nucleo abbiamo invece gli elettroni in movimento, che negli atomi allo stato neutro sono in numero pare a quello dei protoni.
Stando ai principi della meccanica quantistica e in particolare alle conclusioni raggiunte dal fisico Erwin Schrödinger non è possibile determinare in ogni istante la posizione e la velocità di un elettrone. Possiamo perciò dire che intorno al nucleo si trova una nube elettronica, ovvero una regione di spazio c’è un’alta probabilità di trovare un elettrone. Questa risulta più densa in prossimità del nucleo ma si fa via via più rarefatta man mano che ce ne si allontana.
In sintesi ogni atomo è formato per la maggior parte da spazio vuoto: il raggio atomico è circa 10.000 volte più ampio di quello del suo nucleo.
Leggendo la tavola periodica possiamo ricavare subito il numero di protoni ed elettroni presenti in ogni elemento atomico.
I simboli degli elementi chimici sono infatti disposti in ordine di numero atomico (Z) crescente a partire dall’idrogeno, che ha un protone solo, fino al Laurenzio (Lr) che ha Z = 103.
Più aumenta il valore del numero atomico più il nucleo si fa corposo, anche se c’è da considerare che ogni elemento presenta gli isotopi, dove il numero di neutroni può variare.
La scoperta degli elettroni
Partiamo dalle particelle subatomiche che consentono di formare i legami e che in base al loro numero possono conferire carica positiva o negativa a un atomo.
La massa di un elettrone è stimata sui 9,1 x 10-31 kg, presenta una carica elettrica negativa di 1,6 x 1019 C e per indicarlo si utilizza come simbolo e–. Questa carica bilancia con esattezza quella del protone, che invece è positiva.
La scoperta dell’esistenza degli elettroni si deve a un esperimento condotto dal fisico J.J. Thomson nel 1897 utilizzando uno strumento chiamato tubo di Crookes, utilizzato per studiare i raggi catodici. Si tratta di un tubo sotto vuoto contenente un gas molto rarefatto e alle due estremità due elettrodi metallici, un anodo e un catodo. Dal catodo partono dei raggi diretti verso l’anodo che hanno carica elettrica negativa e provocano una lieve fluorescenza.
Thomson decise di calcolare il rapporto carica/massa di tali raggi usando il raggio del tubo: questo ammontava a e/m = 5.273 · 1017 u.e.s./g.
A determinare la carica delle particelle negative dell’atomo invece fu Robert A. Millikan, che ricorse a un esperimento condotto con goccioline d’olio cariche sospese grazie a un campo elettromagnetico.
Le cariche presenti nell’olio erano tutte multiplo di una carica infinitesima: quella dell’elettrone. Grazie a questa proprietà gli elettroni schermano la carica nucleare verso quelli più esterni, contribuendo all’irregolarità delle orbite che descrivo.
Le particelle positive dell’atomo
Sebbene come accennato i protoni abbiano una carica positiva che compensa perfettamente quella degli elettroni, la loro massa a confronto è notevolmente più grande, ovvero 1,67×10−27 kg.
Indichiamo il protone con il simbolo p+ e come abbiamo detto il loro numero corrisponde al numero atomico. La sua scoperta si attribuisce a Ernest Rutherford, il fisico a cui dobbiamo uno dei modelli atomici considerati step fondamentali per arrivare a definire quello odierno.
Grazie al suo esperimento con le particelle α riuscì a comprendere che l’unità atomica non era una massa unica ma c’era uno spazio vuoto al suo interno dove orbitavano gli elettroni.
Protoni e neutroni presi nel loro insieme costituiscono i nucleoni, termine con cui si indicano le particelle che compongono il nucleo dell’atomo.
Se preso in forma libera il protone risulta una particella stabile e quindi non soggetto a decadimento, ma potenzialmente eterno. Infatti al momento non ci sono evidenze sperimentali che questa particella subatomica possa decadere in tali condizioni. Se rimane all’interno del nucleo invece può andare incontro al decadimento beta, in cui può trasformarsi in un neutrone.
La natura del neutrone
Rimane da analizzare ancora una delle particelle subatomiche principali, che ha la peculiarità di avere carica pari a zero. La indichiamo con il simbolo n o n0 e assieme al protone va a comporre nucleo dell’atomo: il neutrone.
La sua massa è pari a quella del protone, in quanto è stimata intorno a 1,67×10−27 kg. A differenze del protone risulta stabile finché rimane nel nucleo, perché una volta rimosso decade rapidamente (circa 15 secondi) andando a formare un elettrone o un protone.
La scoperta di quest’ultima particella risale al 1932 e la si attribuisce a James Chadwick (gli valse il Nobel per la Fisica tre anni più tardi). Identificò i neutroni durante un esperimento in cui stava indirizzando delle particelle α emesse da nuclei del plutonio verso delle lamine di berillio, un metallo alcalino-terroso.