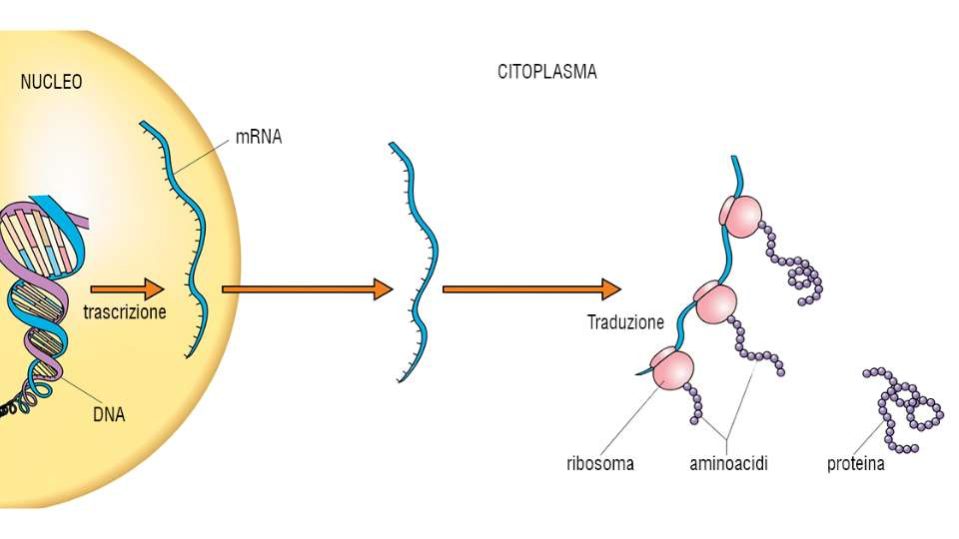
Dai geni alle proteine: la sintesi proteica
Se nel materiale genetico presente nel nucleo delle cellule sono riportate le informazioni per produrre le proteine, è nel citoplasma che queste prendono forma. Il processo biochimico che porta al loro assemblaggio si definisce sintesi proteica e ha luogo a livello dei ribosomi.
Molte delle proteine che si producono con questo processo hanno funzione enzimatica e sono indispensabili per il metabolismo cellulare. Sintetizzarle richiede la ripetizione di tre fasi, che vedremo nel dettaglio di seguito.
Come si arriva ai ribosomi
Per dare inizio alla sintesi proteica è necessario avere a disposizione gli mRNA che trascrivono la sequenza di basi che codifica per gli amminoacidi della proteina. Questi si producono durante la trascrizione del DNA codificante ad opera di enzimi conosciuti come RNA polimerasi.
Una volta trascritto, l’mRNA subisce un processo di maturazione (splicing), che vede l’eliminazione delle sequenze non codificanti (introni) e l’unione di quelle da tradurre a livello dei ribosomi. Da uno stesso trascritto di DNA si possono ricavare varie isoforme di una stessa proteina che possono esercitare funzioni biologiche diverse grazie allo splicing alternativo. In questo caso oltre a rimuovere gli introni alcuni enzimi tagliano parte degli esoni.
La struttura del ribosoma
L’organello dove avviene la sintesi proteica è presente sia nelle cellule procarioti che in quelle eucarioti. Per distinguerli si ricorre al loro coefficiente di sedimentazione, che si misura in Svedberg (S). Per i ribosomi presenti nelle cellule eucarioti questi è pari a 80S, mentre per quelli dei procarioti è 70S.
L’organello è composto da due subunità, una maggiore e una minore, asimmetriche fra di loro. Il solco presente fra le due parti del ribosoma è il sito che accoglierà l’mRNA maturo proveniente dal nucleo.
Sulla subunità maggiore si trovano i siti di legami per i tRNA che intervengono durante la traduzione dell’RNA messaggero.
Questi indicano con le lettere A, P ed E. ll primo si chiama così perché è il sito dove arrivano gli amminoacil-tRNA, il secondo è quello dove si formano i legami peptidici e il terzo è il sito di distacco del tRNA libero.
La prima fase della sintesi proteica: inizio della traduzione
Per partire a costruire la proteina c’è bisogno di assemblare l’apparato traduzionale, composto dal ribosoma, dai fattori traduzionali, dall’mRNA e dagli amminoacil-tRNA. Questi non sono altro che tRNA legati con un legame estere ciascuno a uno specifico amminoacido per opera dell’enzima amminoacil-tRNa-sintetasi.
L’inizio della traduzione vede l’arrivo di un amminoaci-tRNA che porta la metionina negli eucarioti e la formilmetionina nei procarioti, che si lega al sito P.
Subito dopo la subunità minore lega l’mRNA alla sua estremità 5′ e scorre fino a trovare il codone d’inizio della sequenza codificante, ossia AUG. Una volta giunti qui si lega anche la subunità maggiore.
I fattori di traduzione che regolano l’inizio della sintesi proteica a questo punto si staccano. Negli eucarioti sono più di dieci (eIF4G, elF4A, eIF4E…) mentre nei procarioti sono solo tre (IF1, IF2, IF3). Per ora abbiamo quindi un tRNA sul sito P, mentre i siti A ed E del ribosoma sono liberi.
La fase di allungamento
Qui avviene il riconoscimento fra l’anticodone presente sul tRNA e il codone dell’mRNA messaggero. Dopodiché la metionina/formilmetionina presente sul primo tRNA si slega da quest’ultimo per unirsi al nuovo amminoacido con un legame peptidico. Di fatto così inizia la sintesi proteica vera e propria.
La terminazione e il rilascio del polipeptide
La fase di allungamento procede lungo l’mRNA fino a che non trova una tripletta che non corrisponde ad alcun amminoacido. Può essere UAG, UGA oppure UAA, che nell’ambiente scientifico si chiamano anche ambra (UAG), opale (UGA) e ocra (UAA). Dato che non esiste un anticodone complementare questi tre codoni segnano la fine della fase di allungamento.
I geni regolatori della sintesi proteica
Questo processo biochimico non avviene in automatico per tutte le proteine e gli enzimi, perché alcuni vanno prodotti solo in determinate circostanze e in quantità determinate. Alcuni per esempio servono durante alcune fasi dello sviluppo o per far fronte alla presenza di un’infezione.
Il controllo sull’attività di trascrizione per esempio è dovuto alla presenza dei geni regolatori, che possono agire come induttori o repressori dell’enzima RNA-polimerasi. La conoscenza di questi meccanismi di regolazione è fondamentale per la ricerca farmacologica, poiché diversi antibiotici contengono inibitori della sintesi proteica dei batteri.