Il numero atomico e il numero di massa
Per parlare di isotopi prima di tutto dobbiamo introdurre i concetti di numero atomico e numero di massa.
Il primo corrisponde al numero di protoni presenti nel nucleo di un atomo, e si indica con il simbolo Z, mentre il secondo cumula protoni e neutroni e come simbolo ha A. Nella tavola periodica troviamo gli elementi chimici ordinati secondo il valore del loro numero atomico, dall’idrogeno (1) fino al laurenzio (103). Abbiamo elementi diversi se hanno valori di Z che non coincidono, ma può capitare che alcuni atomi abbiano Z uguali e valori di A che variano.
La parola isotopo deriva dal greco ed è formata dai termini ἴσος (stesso) e τόπος (luogo), poiché gli atomi con lo stesso Z corrispondono alla stessa casella della tavola periodica.
Le proprietà degli isotopi
Dopo questa introduzione possiamo quindi definire un isotopo come un atomo di qualsiasi elemento che pur variando di massa atomica rispetto a quella riportata sulla tavola periodica mantiene il numero atomico dell’elemento.
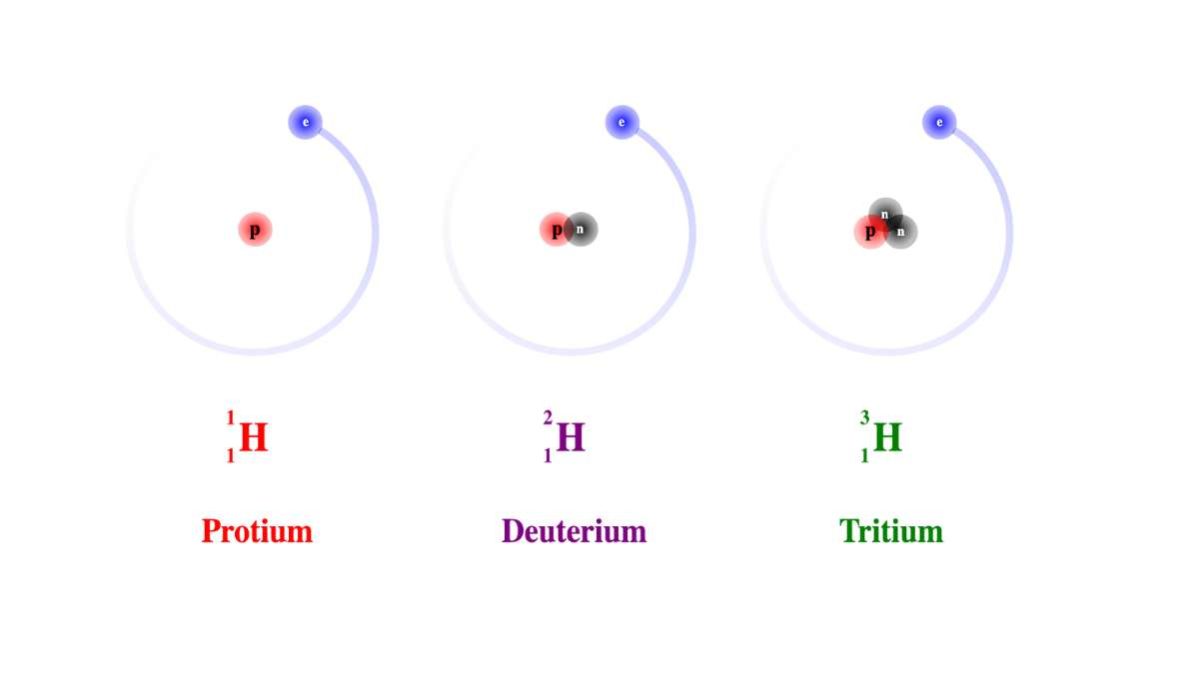
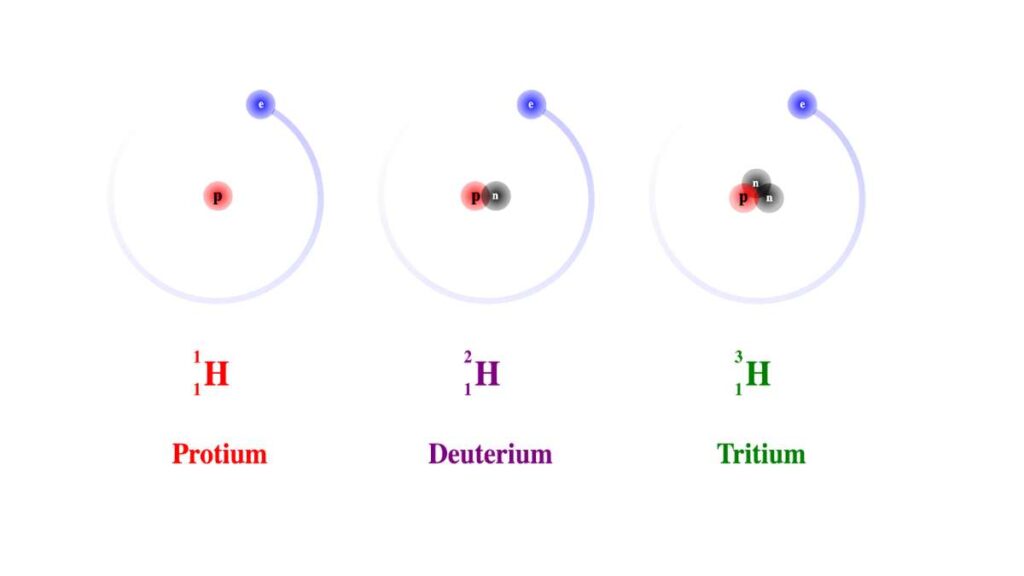
Per esempio nel caso dell’idrogeno abbiamo numero atomico 1, ma sono atomi di idrogeno anche il deuterio e il trizio, che hanno numero di massa 2 e 3 in quanto possiedono rispettivamente uno e due neutroni oltre al protone.
Di fatto ogni elemento chimico è composto in realtà da una miscela di atomi con Z uguale ma A differente.
Possiamo suddividere gli isotopi in due categorie sulla base delle caratteristiche del loro nucleo: stabili o instabili.
Nel primo caso questo si conserva nel tempo restando inalterato, mentre se abbiamo degli atomi instabili va incontro a un processo definito decadimento radioattivo.
Si verifica quando un nucleo instabile cerca di raggiungere la forma più stabile emettendo radiazioni.
Possiamo osservare decadimento α, β, γ in base al tipo di particelle che il nucleo instabile emette, ma solo l’ultimo non modifica la specie chimica di partenza.
Un isotopo stabile, dato che rimane identico con il trascorrere nel tempo, come nel caso del carbonio-12, che rappresenta il 98,89% di questo elemento presente in natura.
Gli atomi instabili invece trovano diverse applicazioni nel campo della medicina e della produzione di energia (es. uranio 235).
Ognuno ha un proprio tempo di dimezzamento, che corrisponde al periodo necessario perché metà degli atomi del campione decadano.
Questa proprietà consente di usarli anche per la datazione dei fossili. Per alcuni atomi il tempo di dimezzamento si calcola in migliaia di anni, per altri è questione di pochi secondi.
Le tipologie di decadimento radioattivo
Vediamo di approfondire i tre processi a cui può andare incontro il nucleo degli isotopi instabili.
Partiamo dal decadimento α, che si verifica quando il nucleo di un atomo emette particelle composte da 2 protoni e due neutroni, ovvero nuclei di elio (He).
In formula possiamo descriverlo nella forma AZXN => A-4Z-2YN-2 + 4zHe2 dove X rappresenta l’atomo di partenza e Y quello successivo al processo di decadimento.
I nuclei di elio, che in questo caso definiamo particelle α, sono estremamente stabili grazie alla loro struttura.
Il decadimento β può presentarsi in tre forme diverse a seconda della particella subatomica che converte.
Nella prima un neutrone in eccesso si trasforma in protone emettendo una particella dotata di carica (particella β), in formula si scrive n => p+ + e– e si classifica come decadimento β–.
C’è poi il decadimento β+, in cui la particella che subisce trasformazione è un protone, secondo il processo p+ => n + e+. Infine abbiamo la cattura elettronica, in cui un protone acquisisce una particella carica negativamente per diventare un neutrone (p + e– => n).
Possiamo descrivere questi tre processi di decadimento degli isotopi instabili in modo più tecnico scrivendo le seguenti formule:
- Nel caso del decadimento β– AZXN => A-4Z+1YN-1+e– .
- Per il decadimento β+ invece abbiamo AZXN => A-4Z-1YN+1e+ .
- Nel caso della cattura elettronica, spesso indicata con la lettera ε, avremo invece AZXN + 1e–=> A-4Z-1YN+1.
I nuclei instabili che vanno incontro a decadimento γ infine emettono fotoni cercando di andare verso lo stadio con minore energia possibile. Questo processo ha in genere i tempi di dimezzamento più brevi.
Gli isotopi dell’idrogeno
Vale a dire il deuterio (2H o D) e il trizio (3H o T).
Il deuterio ha un’abbondanza in natura di appena il 0,015%, mentre per il trizio si scende ancora fino a una percentuale di un atomo ogni 1018 atomi di idrogeno.
L’atomo di idrogeno come si studia di solito, dove il nucleo è formato da un singolo protone, si chiama prozio (1H ).
La formula di questo composto chimico è D2O o 2H2O. Per ottenere l’acqua pesante si ricorre a un processo di distillazione dell’acqua demineralizzata grazie al fatto che la sua temperatura di ebollizione è diversa rispetto all’acqua che contiene prozio.
Le applicazioni in Medicina
L’esame diagnostica prevede la somministrazione di un radiofarmaco al paziente le cui componenti andranno ad interagire con degli specifici tessuti biologici. A questo punto si passa a rilevare la loro distribuzione con uno strumento chiamato gamma-camera.
La gamma-camera restituisce delle immagini bidimensionali fornendo indicazioni precise sia sulla funzionalità degli organi che sulla loro forma e dimensioni. Diversamente dalla TAC e della PET la scintigrafia si limita a registrare le radiazioni emesse dal paziente in seguito all’assunzione del radiofarmaco.