Cosa si intende con ionizzazione
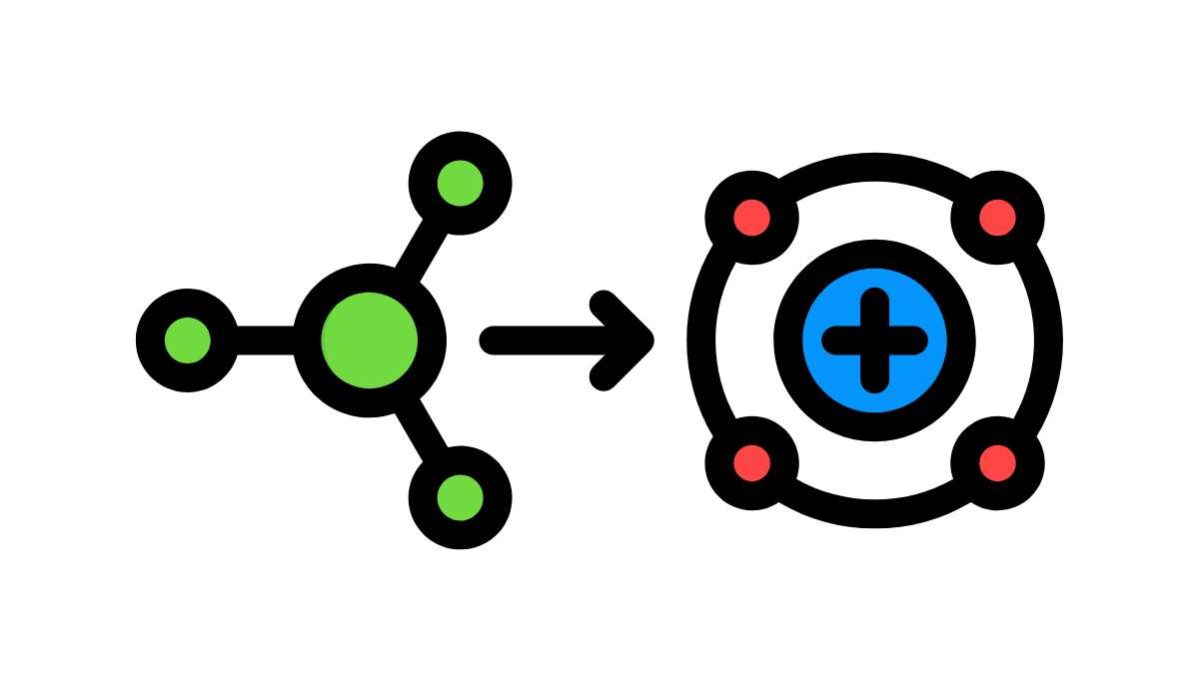
Per dare una definizione chiara di “ionizzazione” possiamo dire che è un processo con cui un atomo o una molecola neutri perdono o acquistano elettroni in più rispetto allo stato neutro. Diventano quindi ioni, ossia atomi o molecole dotati di una carica positiva (+) nel primo caso o negativa (-) nel secondo. Il numero di cariche perse o acquisite si indica di fianco (es. 2+. 3- ecc.).
Gli ioni con una carica positiva si definiscono cationi (es. NH4+), mentre quelli negativi si chiamano anioni (es. OH-). Per definirli meglio, un catione è un atomo o una molecola che ha il numero di protoni superiore a quello degli elettroni, l’anione invece ha i protoni in difetto rispetto agli elettroni.
Il caso dell’autoionizzazione dell’acqua
Esistono diverse tecniche di laboratorio per ottenere ioni a partire da elementi o composti neutri. Per capire meglio il meccanismo però è meglio osservarlo nella sua forma spontanea.
L’acqua grazie alla natura polare della sua molecola è un composto che si presta a formare ioni senza interventi esterni. Basta che due molecole di H2O si avvicinino per reagire e formare un catione idrossido (H3O+) e un anione perossido (OH–).
La reazione che avviene quindi scritta in forma molecolare è 2H2O => H3O+ + OH– . Questo processo di ionizzazione aiuta a spiegare la natura anfotera dell’acqua, ossia la sua capacità di comportarsi sia da acido che da base. Può infatti formare sia ioni H3O+ che OH– a seconda della sostanza con cui viene a contatto.
Oltre alla molecola d’acqua però c’è un altro composto noto per formare ioni in modo spontaneo, ma solo quando si trova allo stato gassoso. Si tratta dell’acido fluoridrico (HF), un reagente molto usato nell’industria chimica per produrre i gas fluororati. Due molecole di HF avvicinandosi reagiscono secondo la seguente reazione: 2HF => H2F+ + F-.
L’energia necessaria per formare uno ione
Per ogni atomo il numero di EI è uguale a quello degli elettroni che possiede, mentre nel caso delle molecole spesso non si possono in genere sottrarre più di uno o due e-. La ragione è legata al semplice fatto che tendono a dissociarsi togliendone di più.
Metodi per indurre la ionizzazione di elementi e molecole
Esistono diverse tecniche per portare alla formazione di ioni, suddivise in “forti” e “soft”. Tra le prima una delle più conosciute è l’elettroionizzazione e prevede di esporre la sostanza a energia pari a 70 elettronvolt (eV). A livello atomico si tratta di una carica molto forte, in grado di rompere i legami intramolecolare con facilità. Si tratta tuttavia di una tecnica imprecisa.
Un sistema “soft” invece è quello della ionizzazione chimica, che si indica con l’acronimo CI. In questo caso il campione si espone a un gas reagente che provoca un trasferimento di protoni e produce perciò ioni positivi.
Dato che questo gas si scalda ad alte temperature è necessario che la molecola da ionizzare sopporti bene gli sbalzi di temperatura. Inoltre la si pone a una pressione inferiore rispetto a quella della sostanza gassosa in modo da dare più forza all’impatto.
Possiamo citare anche la metodologia chimica negativa (NCI), che si può applicare a una grande varietà di piccole molecole modificate per promuovere la cattura degli elettroni da parte del campione. Un esempio sono gli atomi di fluoro (F) o i gruppi nitrobenzilici (derivati da C6H5NO2).
Infine merita menzione il metodo MALDI (Matrix Assisted Laser Desorption Ionization) che prevede un irraggiamento del campione da ionizzare con fotoni laser, dopo averlo mescolato con una matrice solida.
Differenze con la dissociazione ionica
Non è raro sentir parlare di ionizzazione e dissociazione ionica come se fossero sinonimi o confonderle fra loro, ma in realtà si tratta di due processi diversi. La differenza principale è che il primo è una reazione che produce cationi o anioni a partire da una molecola che non presenta legami ionici al suo interno.
La dissociazione ionica invece si limita a separare i composti ionici. Si tratta di molecole dove i legami chimici fra gli atomi si formano grazie alla marcata differenza di elettronegatività (> 1,9) che presentano fra di loro. In questo caso infatti non avviene uno scambio di elettroni come nel caso del legame covalente, ma si forma una grande attrazione di natura elettrostatica.
Un esempio di composto ionico, che perciò non va incontro a ionizzazione ma dissociazione, è il cloruro di sodio (NaCl). Il sodio ha elettronegatività pari a 0,93 appartenendo al primo gruppo, mentre il cloro che appartiene al diciassettesimo ha una valore di 3,16. In acqua quindi questo sale si dissocia negli ioni Na+ e Cl-.
Possiamo aggiungere che la dissociazione ionica è un processo di natura reversibile, al contrario dell’altro che invece risulta irreversibile in tutti casi. Gli ioni che non si formano a partire da un composto di natura non ionica infatti non erano presenti nella molecola iniziale. Pensando sempre al sale se lasciamo che l’acqua in cui abbiamo sciolto NaCl evapori riotterremo la sua forma cristallina.