Cosa unisce il legame peptidico
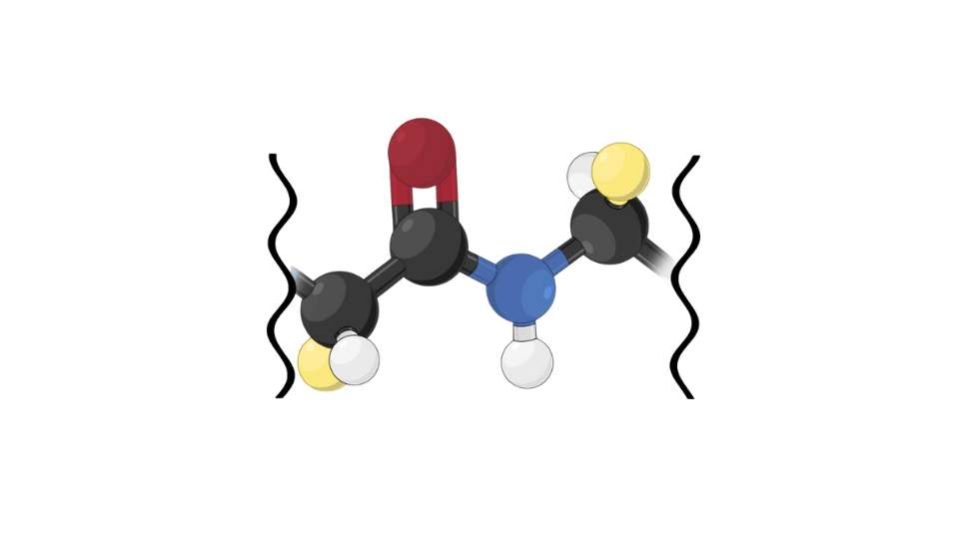
Si definisce così un legame covalente che si forma tra due molecole dove una ha un gruppo carbonilico (-COOH) e l’altra uno amminico (NH3+). Le molecole in questione sono due amminoacidi, che unendosi formano i peptidi e i polipeptidi. Stiamo perciò parlando del legame che porta alla formazione delle proteine, macromolecole che svolgono diversi ruoli fondamentali nel nostro organismo.
La natura di questo legame non rispetta quella del legame singolo e anche per questo merita un’attenta analisi. Ad esaminarlo con attenzione per la prima volta fu Linus Pauling nel 1930.
La reazione che lega due amminoacidi fra loro
La formazione del legame peptidico consiste in una condensazione, ovvero un processo che porta all’eliminazione di una molecola d’acqua. L’H2O si forma tra uno degli idrogeni del gruppo amminico e l’idrossile (-OH) del gruppo carbonilico. Si parla anche di sintesi di disidratazione dato che si elimina acqua, e alla fine della reazione si ottiene un dipeptide, ovvero una catena di due amminoacidi.
All’altra estremità entrambe le molecole che compongono il dipeptide possono legarsi a un altro amminoacido con un’altra reazione di condensazione. Si ottengono così un tripeptide, un tetrapeptide e così via man mano che se ne aggiungono altri. Possiamo osservare questo fenomeno a livello dei ribosomi durante la sintesi proteica.
Nelle cellule la formazione del legame peptidico avviene a livello della subunità maggiore del ribosoma. Man mano che arrivano gli amminoacil-tRNA che trasportano gli amminoacidi corrispondenti ai codoni dell’mRNA la catena amminoacidica si allunga, aggiungendo un amminoacido alla volta. La reazione di condensazione che li lega avviene nel sito P, che significa appunto Peptidico.
L’enzima, o meglio il ribozima che catalizza la condensazione fra il -COOH e l’NH3+ dei due amminoacidi si chiama peptidil transferasi. Si trova appunto nella subunità maggiore del ribosoma ed è dotato di attività catalitica. La sua attività però non è modulata da nessuna proteina ribosomale.
La struttura del legame peptidico
Quando Linus Pauling osservò il legame fra gli amminoacidi utilizzando la diffrazione a raggi X riuscì a capire parecchio riguardo la sua conformazione. Si tratta di una tecnica di analisi fondamentale sia per le analisi delle strutture atomiche che per quelle delle molecole e sfrutta l’interazione fra le radiazioni e la materia. I raggi X infatti subiscono diffusione da parte degli elettroni di legame presenti fra gli atomi. Risulta adatta in particolare per lo studio dei solidi cristallini.
Ciò che si sa è che il legame peptidico presenta una struttura rigida e planare. Il legame risulta un ibrido tra quello semplice e quello doppio: per il 60% rispecchia il primo e per il restante 40% invece presenta carattere simile a quello del doppio legame. La natura parziale di legame doppio conferisce ai gruppi peptidici isomeria cis-trans. Infatti non è possibile la libera rotazione attorno al legame C-N. Tra queste due conformazioni possibili l’isomero più stabile è il trans per via dell’ingombro sterico.
Questa rigidità del legame limita il numero di conformazioni che può assumere una catena polipeptidica. Per questo conosciamo solo due forme possibili di struttura secondaria, limitata dagli angoli di legame fra gli amminoacidi. In particolare gli angoli diedri Φ e Ψ valgono ± 180° se il polipeptide è completamente disteso e i legami fra gli amminoacidi tutti sullo stesso piano.
Il grafico di Ramachandran
Per capire di più del legame peptidico e dei due angoli menzionati prima si usa questo strumento, chiamato anche mappa di Ramachandran. L’angolo Φ è definito dal legame N-Cα, mentre Ψ dal legame Cα-CO. I valori che possono assumere sono limitati a causa dell’ingombro sterico fra gli atomi delle catene laterali degli amminoacidi. L’unico amminoacido che fa eccezione alla regola è la glicina, quello con la struttura più semplice e ingombro sterico trascurabile.
Il grafico creato da G.N. Ramachandran nel 1963 riporta in ordinata i valori di Ψ e in ascissa quelli di Φ. I valori possibili si trovano nell’intervallo fra -180° e +180° ma osservandolo possiamo vedere che alcune zone del piano risultano vuote. Dove non c’è nulla significa che le coppie di valori all’interno di quell’area non sono ammissibili per i residui amminoacidici. Dunque non le troveremo mai all’interno delle strutture delle proteine.
Dividendo il piano cartesiano del grafico di Ramchandran nei quattro quadranti possiamo dire di più. Il legame peptidico può presentare angoli diedri con valori che si trovano soprattutto all’interno del secondo (Ψ positivo e Φ negativo) e del terzo quadrante (sia Φ che Ψ negativi). Una densità più bassa si trova nel primo quadrante, mentre il quarto è praticamente deserto.
Per andare più nello specifico le conformazioni più comuni sono per Φ intorno a -57° e Ψ che vale circa -47°. In questo caso troviamo la struttura secondaria dell’α-elica. Se invece abbiamo il valore di Φ che si aggira intorno a -130° o -140° e quello di Ψ sui +135° abbiamo la struttura β foglietto ripiegato.