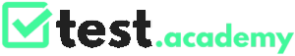La molarità e la concentrazione della soluzioni
Durante lo studio delle soluzioni in chimica si introducono diversi sistemi per definire quale sia la concentrazione del soluto. Fra questi oltre a quello che esamineremo in dettaglio di seguito possiamo ricordare la concentrazione percentuale massa/massa (m/m), quella Volume/Volume (V/V) e per finire la percentuale massa/Volume (m/V).
Per chiarezza possiamo anticipare che tutte queste concentrazioni, compresa quella in esame, si basano su un rapporto fra la quantità di soluto e la soluzione nel suo insieme. Non bisogna confondere solvente e soluzione, poiché spesso la differenza in termini di massa o volume è ingente.
Definizione, formula e calcolo
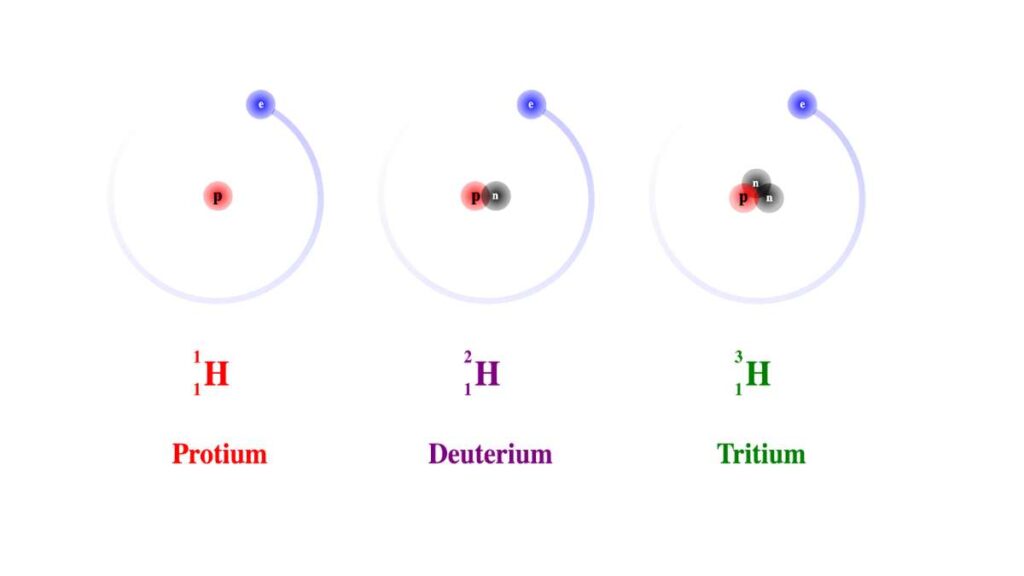
Possiamo definire la molarità come il rapporto fra il numero delle moli di soluto e il volume della soluzione in cui questo risulta disciolto. Per rinfrescare il concetto, la mole è la quantità di sostanza pura o composto che corrisponde a un numero di Avogadro di atomi e molecole ( 6,02214076×1023 mol−1). La consideriamo anche come una quantità in grammi di sostanza o composto che corrisponde (dal punto di vista numerico) alla massa molecolare o atomica. Questo significa che una mole può avere massa molto diversa in base all’elemento o al composto considerato.
La formula che si utilizza per calcolarla è la seguente: M = nsoluto/Vsoluzione. Il volume si esprime in litri anziché in mL come avviene nel caso delle concentrazioni percentuali m/V e V/V. L’unità di misura di conseguenza è la mole su litro (mol/L) e per indicare la concentrazione in moli si rappresenta il simbolo chimico del soluto fra parentesi quadre. Per esempio [NaCl], [HCl] ecc.
Per fare un esempio, supponiamo di avere una soluzione in cui sono disciolte 2,5 moli di cloruro di potassio (KCl) di volume pari a 1300 mL. Calcolare la sua molarità è facile, una volta fatta l’equivalenza per avere il volume espresso in litri, ovvero 1,3 L. Usando la formula vista sopra è M = 2,5/1,3 = 1,92 mol/L.
Qualora la quantità di soluto sia espressa in grammi occorre prima determinare questi a quante moli di composto o sostanza pura corrispondano. Occorre perciò fare un calcolo in più, usando la formula nmoli = massasoluto/MM. La sigla MM sta per massa molecolare, ricavabile dalla somma delle singole masse atomiche espresse in u.m.a. sulla tavola periodica.
L’errore comune fra molarità e molalità
Come accennato all’inizio, bisogna fare sempre attenzione a non confondere il solvente con la soluzione, poiché quest’ultima è l’insieme di soluto e solvente. Calcolarla confondendo questi due elementi può portare a una facile sovrastima e quindi a gravi errori se rapportati nel pratico. Un errore anche peggiore però è confonderla con un’altra misura della concentrazione delle soluzioni, ossia la molalità.
Naturalmente considerando che tra le due cambia appena una lettera, e anche il simbolo è simile (m per la molalità) risulta facile confonderle già leggendo il testo di un problema. Nonostante queste somiglianze però la molalità è una grandezza molto diversa. Rapporta infatti le moli di soluto con la massa della soluzione e non con il suo volume.
Una soluzione che ha molarità pari a 1 contiene una mole di soluto ogni litro di soluzione. Ma se la stessa soluzione ha molalità pari a 1 significa che la mole si trova in un chilogrammo di solvente. La massa cambia in base alla densità della soluzione, e dunque le due grandezze non coincidono praticamente mai. Un’altra differenza fra le due è il fatto che la molalità non risenta affatto dell’influenza della temperatura.
Sebbene si possa obiettare che nel caso dell’acqua volume e massa coincidano c’è da considerare la presenza del soluto. La sua presenza infatti influenza il valore della densità, che quindi cambia rispetto al valore che ha per il solvente puro.