Perché parliamo di peso e massa molecolare
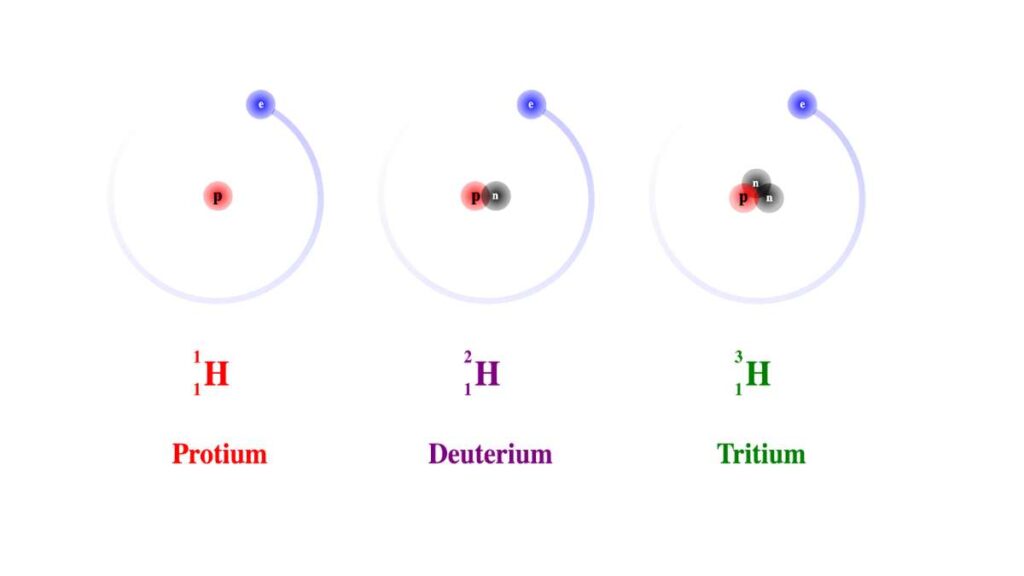
Sappiamo che atomi e molecole sono particelle di dimensioni infinitesime, difficili anche da concepire. Pensare di definirne le dimensioni sembra assurdo, eppure esistono ben due grandezze che cercano di darcene un’idea. Diventa difficile usare chili o grammi per quantificare massa e peso di queste particelle, quindi ricorriamo a unità di misura a sé stanti, come l’u.m.a..
L’u.m.a. è l’unità di massa atomica, che si stima pari a 1,660539×10−27 g. Per determinarla si è utilizzato come standard l’atomo di carbonio 12 (12C) in base a cui si calcolano quelle di tutti gli altri elementi.
Come si determina il peso molecolare
Partiamo da questo concetto per poi arrivare alla massa molecolare. Per definizione questo non è altro che la somma dei pesi atomici dei diversi atomi che vanno a comporre la molecola. Una quantità adimensionale che possiamo trovare solo usando le stime indicate nella tavola periodica degli elementi.
A ogni elemento infatti corrisponde un peso atomico quantificato in u.m.a. Proprio in base a questo valore si dispongono gli elementi lungo i periodi della tavola dall’idrogeno (H) che ha peso pari a 1,008 u.m.a. fino all’oganesson (Og), un elemento artificiale che vale ben 294 u.m.a.
Quando si scrive la formula molecolare di un composto sappiamo già quanti atomi e di quali elementi questa contiene. Per stimare il peso molecolare di un sale come NaCl, un composto che contiene un atomo di sodio (Na) e uno di cloro (Cl), basta sommare i due valori. Il peso atomica del sodio è di circa 23 u.m.a. e il cloro invece di 35,45 u.m.a., quindi sommandoli otteniamo che la molecola NaCl ne avrà uno di 58,45 u.m.a.
Se abbiamo una molecola più complessa come Ba(OH)2, dove abbiamo il gruppo idrossilico preso due volte, bisogna fare un calcolo in più. Serve quindi il peso del bario (Ba) più quella di idrogeno e di ossigeno moltiplicate per due dato che (OH)2 significa due atomi di ossigeno e due di idrogeno. Il pedice accanto alle parentesi tonde indica il numero per cui moltiplicare gli atomi degli elementi indicati all’interno.
In cosa consiste la massa molecolare
Passiamo alla seconda grandezza in esame insieme al peso molecolare, ossia la massa. Quando parliamo di massa atomica ci riferiamo a quante volte questo risulta maggiore dell’unità di massa atomica espressa in chilogrammi, ovvero 1,660539×10−27 g. Dunque visto che l’idrogeno ha peso pari a 1,008 u.m.a. allora la sua massa si potrà ricavare moltiplicando 1,008 per il fattore 1,660539×10−27 g. Il risultato dell’operazione è 1,673 x 10−27 g. Invece per un atomo più corposo come quello dell’uranio (Ur) che è pari a 238 u.m.a. la massa atomica ammonta a 3,95 x 10−25 g.
La massa molecolare invece, come per la massa, si ricava dalla somma delle singole masse atomiche degli atomi presenti nella formula molecolare del composto. Occorre quindi verificare il peso in u.m.a. sulla tavola periodica, convertire questa misura in grammi per ogni atomo e poi procedere alla somma. Volendo per fare un calcolo più rapido si possono sommare i pesi in u.m.a. e solo alla fine effettuare la conversione moltiplicando per il fattore 1,660539 × 10−27 g.
Prendendo per esempio la molecola del bromuro di potassio (KBr). Il peso molecolare del potassio (K) riportata sulla tavola è 39,1 u.m.a., mentre quella del bromo è di 79,9 u.m.a. Sommate danno 119 u.m.a., e di conseguenza la massa molecolare del bromuro di potassio ammonterà a 1,975 x 10−25 g.
Anche per molecole più articolate come il glucosio (C6H12O6) non serve altro che ricavare moltiplicare i pesi atomici per il numero di atomi e poi finire con la conversione in massa.
La differenza fra peso e massa molecolare
Proviamo ora a riassumere quanto detto prima per esaminare somiglianze e differenze fra queste grandezze. Il peso molecolare come già anticipato è adimensionale a differenza della massa che cerca di dare un valore traducibile in unità note come i grammi. Di fatto quindi vediamo dei concetti che hanno poco a che vedere con massa e peso classici, dove il secondo è una grandezza vettoriale che deriva dal prodotto della massa per l’accelerazione di gravità.
La massa molecolare proprio perché si tratta di una grandezza tangibile torna molto utile per i calcoli richiesti dalle reazioni chimiche. Grazie alla costante di Avogadro (6,02214076×1023 mol−1) possiamo infatti stabilire la corrispondenza approssimativa fra le u.m.a. di un composto molecolare e i grammi di una mole di sostanza.
Dato che i coefficienti stechiometrici indicano il rapporto molare tra i reagenti per portare alla fine la reazione possiamo capire quanti grammi procurarci per ottenere i prodotti desiderati. In più possiamo conoscere anche la quantità che ricaveremo dai grammi di reagenti utilizzati.
Il calcolo delle moli
Considerata la corrispondenza accennata prima fra massa molecolare e moli però ciò vuol dire anche che per ogni mole di gas ne servono due di ossigeno. E come si misura? Semplicemente pesando i grammi corrispondenti alle u,m.a. stimate con il peso molecolare. Quando invece c’è già una quantità in grammi a disposizione occorre a capire a quante moli corrisponda.
Il calcolo necessario si riassume nella formula n(moli) = g(sostanza)/M (massa molare). Quindi il numero delle moli si calcola dal rapporto fra i grammi a disposizione e la massa molare, cioè i grammi a cui ammonta una mole di composto. Se abbiamo per esempio 75 grammi di ferro (Fe) sulla tavola periodica vediamo che ha peso atomico pari a 55,84 u.m.a. Se vogliamo sapere quante moli abbiamo a disposizione dobbiamo fare 75/55,84 = 1,34 moli.